診断方法
図1.の付帯事項
- *1
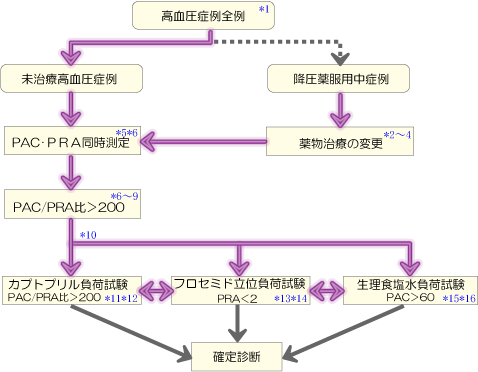
- 腎実質性高血圧、腎血管性高血圧、内分泌性高血圧、大動脈縮窄症、脳幹部血管圧迫、睡眠時無呼吸症候群、薬剤誘発性高血圧など二次性高血圧の除外の一環として、ここに示したスクリーニングを行う。
- *2
- 高血圧の重症度に応じて *3 に述べる薬物に変更して、PAC/PRA測定を行う(利尿薬、アルドステロン拮抗薬は 6 週間以上、β遮断薬は 2 週間以上前に中止する)。
- *3
- 薬物は以下を用いて治療する。
(1) ブトララジン
(2) α遮断薬:ドキサゾシンなど
(3) Ca拮抗薬:マニジピン、ニフェジピン徐放薬、アムロジピンなど
ただし、これらの薬剤もRAA系に影響がある。Ca拮抗薬には、薬理学的作用としてアルドステロンの合成やその作用の抑制があると報告されており、原発性アルドステロン症の診断が困難となる場合がある。 - *4
- *3 の 3 薬では血圧コントロールが不十分な症例では、ARB・ACE 阻害薬の追加も考慮する
- *5
- 採血は座位で 15 分間安静後に行ってもよい(可能な限り 30 分安静臥位での採血がよい)。
(1) PAC : 血漿アルドステロン濃度(pg/mL)
(2) PRA : 血漿レニン活性(ng/mL/h)
※ 諸外国の文献では、PAC の単位として ng/dL が用いられることが多いので注意が必要である。 - *6
- 採血時間は午前を推奨するが、午後の採血では PAC が低下することが知られているので、難治性高血圧症例で多くの降圧薬使用中にスクリーニング検査を行った場合や午後に採血を行った場合は PAC/PRA比(ARR) < 200 であっても慎重に判断する(なお、最近増悪した高血圧や難治性高血圧症例で、午後の採血において ARR < 200 の場合、午前中の ARR の再検査が有用なことがある)。
- *7
- 高齢者では PRA 低値を示し ARR が増加するため、偽陽性となる例があり、PAC の絶対値 (> 120~150 pg/mL)を併用すると特異度があがる。一方で初期の原発性アルドステロン症が見逃されるリスクにも留意する。また、腎障害、腎不全、透析中では、PRAは低値~高値と様々であり、判定が困難な場合がある。
- *8
- 高血圧が重症の例(アルドステロン分泌が著しい)では ARB・ACE 阻害薬服用中でも評価可能である。
- *9
- PRA の代わりに活性レニン濃度(active renin concentration: ARC : pg/mL)使用の際は PAC/ARC比 > 40で判定する。ARC を用いる場合は、PAC、ARC ともに採血後は検体を室温保存できる利点がある。氷冷すると cryoactivation により ARC 高値となるので注意が必要である。
確定診断方法
ARR が高値の場合は、副腎静脈採血による病型分類の前に、3 つの確認検査(カプトプリル負荷試験、フロセミド立位負荷試験、生理食塩水負荷試験)の内 2 種以上の検査を行い、確定診断を行うことを推奨する(図1.)。なお、これらの検査は原則として専門医療機関で行う。
- *10
- 以後の精査は低K血症を補正してから行う。JSH2009 に従い塩分制限を行う場合には、検査結果の評価にあたり、PRA 上昇により ARR の低下が生じる可能性を考慮すべきである。
【カプトプリル負荷試験】
- *11
- カプトプリルによる血管性浮腫、腎血管性高血圧での過度の降圧に伴うショックに注意が必要である。
- *12
- カプトプリル負荷試験

【フロセミド立位負荷試験】
- *13
- 脳心血管イベントリスクが高い動脈硬化進行例・不整脈が誘発されうる症例などでは行わない。
- *14
- フロセミド立位負荷試験
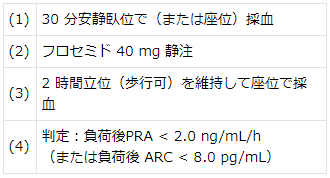
【生理食塩水負荷試験】
- *15
- 心機能低下例・心不全が疑われる症例などでは行わない
- *16
- 生理食塩水負荷試験:入院で行うことが望ましい

- 備考 :
- 生理食塩水負荷試験が実施困難な例では、経口食塩負荷試験でも確定診断が可能であり、外来検査でも実施可能である。ただし、重症の心不全や重篤な不整脈を有する症例では、入院での実施が望ましい。
経口食塩負荷試験

病型分類
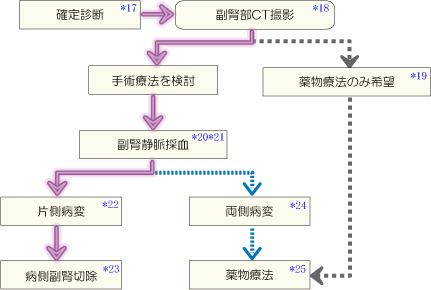
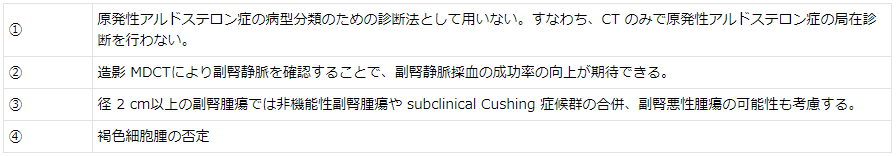
原発性アルドステロン症と診断された患者では腹部 CT を実施するが、副腎腫瘍が確認された場合でも非機能性副腎腺腫、褐色細胞腫、Cushing 症候群や subclinical Cushing 症候群のコルチゾール産生腺腫、副腎癌の合併の可能性についても十分な検索を行う。
患者が外科的処置可能な身体状況であり、外科手術による原発性アルドステロン症の治療を希望する場合は、副腎静脈採血(adrenal venous sampling:AVS)を行ってアルドステロンの過剰分泌部位が両側性なのか片側性なのか、また片側性であれば右副腎が原因か左副腎が原因かを鑑別することが必要となる。
図2. の付帯事項
- *17
- 副腎静脈採血可能施設との連携を考慮する
- *18
- 画像診断
(1) CT撮影 : 下記を考慮しながら行う
(2) デキサメタゾン抑制 131I-アドステロールシンチ : 下記を考慮のうえ必要な際に施行

- *19
- 手術療法を希望しないものは、副腎静脈採血は行わない
(アルドステロン産生腺腫の薬物療法と手術療法の長期予後成績を比較した無作為化比較試験の報告はないが、厚生省特定疾患「副腎ホルモン産生異常症」調査研究班が平成 4 ~ 8 年に実施した「副腎ホルモン産生異常症の全国疫学調査」においては、片側アルドステロン産生腺腫における高血圧と低K血症の改善率が、手術療法を行った群で、薬物療法単独群よりもやや良好となっている)。 - *20
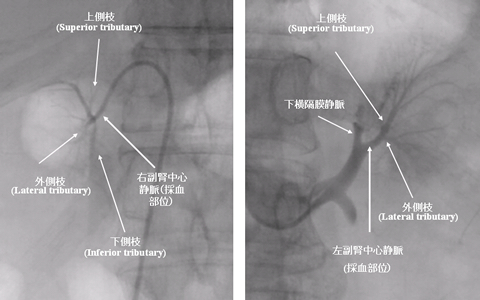
- 副腎静脈採血法(AVS法)
副腎静脈採血の目的
原発性アルドステロン症症例でのアルドステロン過剰分泌部位が両側副腎か片側副腎か、そして片側である場合右副腎か左副腎かを決定し、手術治療の適応を決定する。
副腎静脈採血の適応
原発性アルドステロン症の確認検査で原発性アルドステロン症と診断され、適応があれば手術を希望する症例
副腎静脈採血の実施方法

- 附記 :
- 診断正確度を向上させるためにACTH刺激を行なうことが望ましい。
左右同時採血を行なう場合は、左副腎静脈からの採血の後、左副腎静脈用カテーテルもACTH負荷後採血終了まで左副腎静脈に留置する。
- *21
- 副腎静脈採血の判定基準

- 注意 :
- 判定基準については本邦での報告の成績に基づいた一案を提示した。今後多くの施設での判定基準をもとに再検討されるべき点でもある。従って、上記①、②の判定が同一症例で乖離する時は、画像検査などと合わせて総合的に局在診断を判定することとする。
- 附記 :
-
1. グルココルチコイド奏功性アルドステロン症(GRA)とは、極めて稀な疾患である。原発性アルドステロン症にて常染色体優性遺伝を示す例、小児期発症例、外科的およびに内科的治療に抵抗する症例等では GRAを考慮する。
2. デキサメタゾン抑制試験を行いコルチゾールの自律性分泌が疑われる症例では、コルチゾール濃度による副腎静脈へのカテーテル挿入の判定は行わず、A/C比による判定基準も用いない。
治 療
原発性アルドステロン症は、病型により治療法が異なるため、病型分類が重要である。
- 副腎静脈採血で、片側副腎からのアルドステロン過剰分泌が原因と診断された場合は、腹腔鏡下内視鏡的副腎摘出術の適応となる。その方法は、
ア)経腹膜到達法(経腹膜前方到達法、経腹膜側方到達法がある)、
並びに、
イ)後腹膜到達法(後腹膜側方到達法と後腹膜後方到達法がある)である。
経験を積んだ施設において安全に腹腔鏡による待機手術を受けることが望ましい。 日本泌尿器科学会と日本Endourology and ESWL学会では泌尿器腹腔鏡技術認定制度を導入しており、技術認定取得者の一覧は学会ホームページにて閲覧可能である(https://www.jsee.jp/certify/) 。 摘出後は、病理検索で最終診断する。
APAとIHAはH.E染色でともに副腎皮質球状層の過形成が認められるため、APA特に微細なAPAとIHAの鑑別にはステロイド合成酵素の免疫組織染色による診断が重要である。 アルドステロン合成酵素の染色には凍結切片が必要となるが、ホルマリン標本で染色可能な 3β-hydroxysteroid dehydrogenase(3β-HSD)染色でも診断が可能である。 IHA では過形成を生じた副腎皮質球状層ではアルドステロン合成酵素(P450Aldo)と 3β-HSD が陽性であるが、 APA に随伴する副腎皮質球状層の過形成では P450Aldo と 3β-HSD の発現に減弱が認められる。 - 両側からのアルドステロン過剰分泌が原因の場合、または片側性と診断されても手術不能な場合や患者が手術を望まない場合は、内科的治療としてアルドステロン拮抗薬の使用を推奨する。
- *22
- 片側副腎からのアルドステロン過剰分泌が確認された場合は手術適応となる。
- *23
- 対側副腎病変が否定されている際は、病側副腎全摘を基本とする。病側副腎に腫瘍が存在する場合でも、腫瘍がアルドステロン産生腺腫ではなく、画像診断では確認できない微小なアルドステロン産生腺腫が腫瘍以外の部位に存在する可能性があるため、原則的には腫瘍核出術ではなく全摘とする。
- *24
- 両側副腎からのアルドステロン過剰分泌が確認された際は、薬物療法が基本となる。しかし片側副腎に腫瘍像を認め、コルチゾール産生腫瘍の合併或いは、悪性腫瘍を否定できない際は片側副腎切除も考慮する。また、診断時に腫瘍を認めない例も副腎腫瘍の出現を考慮して経時的観察を行う。
- *25
- 長期予後が確認された薬物療法はないが、スピロノラクトン・エプレレノンなどのアルドステロン拮抗薬を中心に、必要に応じてCa拮抗薬などの降圧薬を組み合わせる(Ca拮抗薬によるアルドステロン分泌抑制の報告あり)。
日本内分泌学会. 「原発性アルドステロン症の診断治療ガイドライン-2009-」
当該事業における対象基準
治療で補充療法、機能抑制療法その他薬物療法のいずれか1つ以上を行っている場合
- 版
- :バージョン1.1
- 更新日
- :2025年6月27日
- 文責
- :日本小児内分泌学会